关于专利申请中序列表的最新规定
2022-07-01文/北京集佳知识产权代理有限公司 刘瑾
2022年5月20日,美国专利商标局(USPTO)发布了一项最终规则,对2022年7月1日或之后向USPTO提交的申请中的核苷酸和氨基酸序列表(Sequence Listing)实施 WIPO ST.26标准,以及对其他实施细则进行相应修订(参见联邦公报30806)。该最终规则基于并明确纳入WIPO ST.26标准的相关部分,创建了新规则,即新的37 CFR 1.831-1.835。此外,37 CFR 1.821-1.834通过引用特别纳入了WIPO标准ST.26的某些规定。
众所周知,生物医药领域的发明通常涉及使用或改造多核苷酸(DNA、RNA等)和/或多肽(抗体或其片段、多肽类激素、具有治疗作用的多肽等),因此,各国专利法均对此类申请做出规定,要求申请人在提交的申请中需包含核苷酸和/或氨基酸序列表(Sequence Listing),也就是说,序列表被视为原始说明书的一部分。特别是当要求保护的技术方案(权利要求)涉及包含一个或多个核苷酸/氨基酸序列时,在提交的申请中公开序列是必需的。
该规定主要是为了满足发明充分公开的要求,并使本领域普通技术人员可以根据说明书公开内容来实施该发明。比如,对于抗体申请,即使所述抗体针对的是现有技术熟知的抗原,其序列也是完全无法预测的,关键区域个别氨基酸的改变有可能带来抗体性质的意想不到的改变,如果申请中没有记载抗体相关序列,本领域普通技术人员是根本不可能实施该发明的。
序列可以记载在说明书正文部分,提交申请的同时提交序列表文件;如果提交申请时未提交序列表,但说明书记载有完整序列信息,通常会收到官方补正通知,要求申请人补交序列表,不改变原申请日。序列本身也可以不直接显示在说明书中,仅在相应位置记载序列编号(SEQ ID NO:),提交申请的同时提交序列表文件;如果提交申请时未提交序列表,而说明书也没有记载完整序列的信息,将不会收到官方补正通知,申请很可能会在审查过程中受到公开不充分/不可实施的质疑,即便获得授权,也容易受到攻击(比如无效宣告)而导致权利的不稳定。
为方便申请人制作符合规定的序列表,USPTO之前提供了一个计算机程序Patent-In,申请人可在程序中输入相关序列信息,即可输出符合要求的计算机可读的序列表用于提交。Patent-In输出的序列表为文本格式,符合WIPO ST.25的规定,但并不符合WIPO ST.26标准。
而WIPO在第五十四届(第 25 届普通会议),2021年10月4日至10月8日,宣布了关于核苷酸和氨基酸序列表(Sequence Listing)的最新标准,即WIPO ST.26。该标准从2022 年7月1日起实施。也就是说,2022年7月1日或之后提交的PCT申请的序列表需符合最新标准WIPO ST.26。
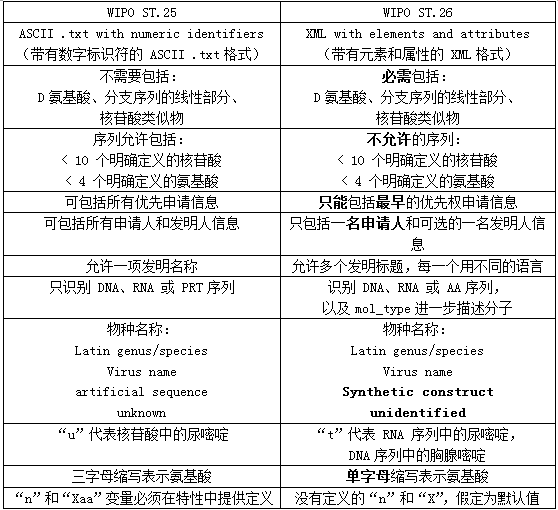
现将WIPO ST.25和WIPO ST.26的主要区别列举如下:
符合WIPO ST.26标准的序列表可通过WIPO Sequence Suite程序制作,WIPO提供该程序的免费下载及操作手册。申请人也可以自由使用其他软件来准备序列表,在这种情况下,应该使用WIPO Sequence软件的序列表验证功能来验证序列表是否符合标准。即使序列表是使用 WIPO软件编制的,仍然建议使用验证功能来检查序列表的正确性和完整性。
在WIPO宣布自2022 年 7 月 1 日起对申请中的序列表实施WIPO ST.26标准后,几个主要国家/地区的官方机构进行了回应:
国家知识产权局(CNIPA)于2022年6月14日发布了“关于调整核苷酸或氨基酸序列表电子文件标准的公告(第485号)”,自2022年7月1日起,向国家知识产权局提交的国家专利申请和PCT国际申请,专利申请文件中含有序列表的,该序列表电子文件应符合WIPO ST.26标准要求。此外,专利申请人以电子形式提交国家专利申请,在提交符合WIPO ST.26标准的序列表电子文件时,为核算说明书附加费用,应同时提交一份PDF格式的序列表文件。
欧洲专利局(EPO)也在2021年12月09日进行了公告,要求自2022年7月1日起向EPO提交的国家专利申请和PCT国际申请的序列表电子文件应符合WIPO ST.26标准要求。申请日在2022年7月1日之前的申请仍需采用WIPO ST.25标准。
日本专利局(JPO)也进行了公告,要求自2022年7月1日起向JPO提交的国家专利申请和PCT国际申请的序列表电子文件应符合WIPO ST.26标准要求。
因此,对于生物医药领域申请人和代理人来说,2022 年 7 月 1 日或之后提交的申请,只需要制作一份符合WIPO ST.26标准的序列表,即可满足在不同国家提交的需要。